Chromosomen-Ultrastruktur
Ultrastrukturelle Untersuchungen an Chromosomen
Während der Mitose, in der Chromosomen kondensieren, sich teilen und zu Tochterzellen segregieren, unterliegen Chromosomen extremen strukturellen Veränderungen. Ein Schwerpunkt unserer Forschung ist die hochauflösende Rasterelektronenmikroskopie an Pflanzen- und Tierchromosomen.
Nach spezieller Fixierung und ultradünner Metallbeschichtung gelingt es, die Ultrastruktur von Chromosomen mit einer Auflösung im Nanometerbereich (1 nm = 1/1000 000 mm) darzustellen. Durch spezielle Präparationstechniken ist es möglich, das Chromatin in allen Kondensationsstufen dreidimensional darzustellen. Strukturelle Details, wie Centromer-, Telomer- oder Satellitregionen, über die derzeit lediglich Modellvorstellungen existieren, können bei über 100 000–facher Vergrößerung untersucht werden. Im Vordergrund stehen dabei u.a. die simultane Darstellung der Chromosomentopographie und der DNA-Verteilung. Dies gelingt durch Imprägnierung der Chromosomen mit DNA-spezifischen Schwermetallverbindungen, z.B. "Platinblau", und mit Hilfe eines speziellen "Rückstreuelektronendetektors". Erstmals konnten auch Proteine und DNA Sequenzen im Chromosom mit Hilfe von goldmarkierten Antikörpern nachgewiesen werden. Die jahrelangen Untersuchungen führten zu einem neuen Chromosomenmodell, das "Dynamic Matrix Model", das erstmals auf strukturellen Daten basiert. Es erklärt die Chromosomenkondensation während der Mitose auf verblüffend einfache Weise.
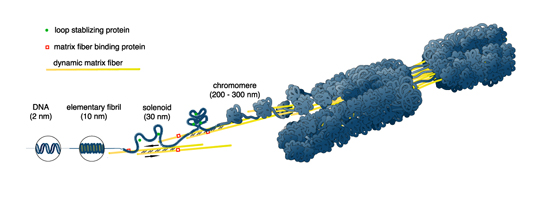
Dynamic Matrix Model
Schematic representation of the Dynamic Matrix Model for chromatin condensation. DNA assembles with histone octamers to form nucleosomes and elementary fibrils which wind up to solenoids. Solenoids attach to matrix fibers by matrix fiber binding proteins. Dynamic matrix fibers move in an antiparallel fashion (arrows), possibly assisted by linker proteins. As condensation progressess, chromomeres are formed by loop stabilizing proteins, and the chromsomes become shorter and thicker as more chromomeres are formed. The resulting tension vertical to the axial direction contributes to the forces separating the chromatids.
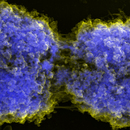
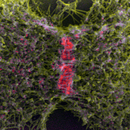
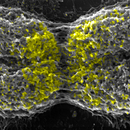
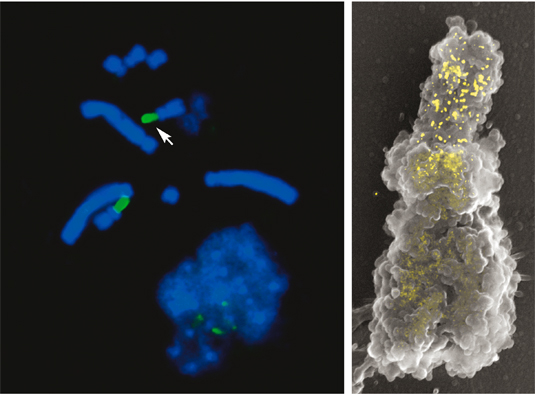
Rasterelektronenmikroskopische Aufnahmen vom Centromer Region isolierter Gerstenchromosomen (Signalmischung von Sekundär- und Rückstreuelektronen). DNA-spezifische Platinblau Kontrastierung (linkes Bild, blau) zeigt, dass das Centromer in Metaphase-Chromosomen DNA-arm ist. Kontrastierung von Proteine als Substanzklasse mit einer Silberverbindung (mittleres Bild, rot) zeigt ein starkes Signal am Centromer. Immunomarkierung von phosphorylierten Histon H3 (ser10) (rechtes Bild, gelb) zeigt eine "Signallücke" im Centromer in der Metaphase.
Epigenetische Modifizierungen von Chromatin
Es besteht ein Zusammenhang zwischen der epigenetischen und der strukturellen Dynamik des Chromatins. Ein Beispiel ist die Verteilung von H3P (= phosphoryliertes Histon H3 Serin 10). H3P ist in Pflanzen während der Mitose überwiegend im perizentrischen Bereich lokalisiert und ist u.a. an der Schwesterchromatiden-Kohäsion beteiligt. Mit hochauflösender Rasterelektronenmikroskopie konnte erstmals die dynamische Verteilung vom H3P in Gerstenchromosomen während der Metaphase mit strukturellen Änderungen im Centromer korreliert werden.
Ultrastruktur von Centromeren und NORs
Die Centromerregion und die nucleolus organizing region (NOR) weisen meist auffällige, hochgeordnete Strukturmerkmale in Form von primären bzw. sekundären Einschnürung der Chromosomen auf. Aktuelle Untersuchungen konzentrieren sich auf die Identifizierung und strukturelle Charakterisierung von Centromer-Strukturvarianten (holocentrische, acrocentrisch, telocentrisch) sowie NOR-Strukturvarianten (u.a. terminale und interstitiale NORs). Wir erwarten dadurch wichtige Informationen über die Zusammenhänge zwischen Strukturvariation und einheitlichem, stark konserviertem Funktionsprinzip.
DFG-Projekt: "Structure and function of plant and mammalian chromosomes: high resolution scanning electron microscopic structural analysis and localization of DNA and Proteins with heavy metal staining and immunogold labelling"(GZ SCHR 1157/2-1)
Publikationen zum Thema
Schroeder-Reiter, E. and Wanner, G. (in press) Chromosome Centromeres: Structural and Analytical Investigations with High Resolution Scanning Electron Microscopy in Combination with Focused Ion Beam Milling. Cytogenet Gen Res.
Schroeder-Reiter, E., Pérez-Willard, F., Zeile, U., Wanner, G. (2009). Focused ion beam (FIB) combined with high resolution scanning electron microscopy: A promising tool for 3D analysis of chromosome architecture. J Struct Biol. 165 (2): 97-106.
Wanner, G. and Schroeder-Reiter, E. (2008) Scanning electron microscopy of chromosomes. Methods Cell Biol 88: 451-474.
Houben A, Schroeder-Reiter E, Nagaki K, Nasuda S, Wanner G, Murata M, Endo T (2007) CENH3 interacts with the centromeric retrotransposon cereba and GC-rich satellites and locates to centromeric substructures in barley. Chromosoma 116:275-283.
Metcalfe, C.J., Bulazel, K.V., Ferreri, G.C., Schroeder-Reiter, E., Wanner, G., Rens,W., Obergfell, C., Eldridge, M.D.B., O'Neill, R.J. (2007) Genomic Instability within Centromeres of Interspecific Marsupial Hybrids. Genetics 177: 2507-2517.
Schroeder-Reiter E, Houben A, Grau J, Wanner G (2006) Characterization of a peg-like terminal NOR structure wit light microscopy and high-resolution scanning electron microscopy. Chromosoma 115: 50-59.
Wanner G, Schroeder-Reiter E, Formanek H (2005) 3D Analysis of chromosome architecture: advantages and limitations with SEM. Cytogenetic and Genome Research 109:70-78.
Zoller, J. F., Herrmann, R. G., Wanner, G. (2004) Chromosome Condensation in Mitosis and Meiosis of Rye (Secale cereale L.). Cytogenet. Genome Res. 105, 134-144.
Zoller, J. F., Hohmann, U., Herrmann, R. G., Wanner, G. (2004) Ultrastructural Analysis of Chromatin in Meiosis I and II of Rye (Secale cereale L.). Cytogenet. Genome Res. 105, 145-156.
Schroeder-Reiter E, Houben A, Wanner G (2003) Immunogold lableing of chromosomes for scanning electron microscopy: a closer look at phosphorylated histone H3 in mitotic metaphase chromosomes of Hordeum vulgare. Chromosome Research 11: 585-596.
Wanner G and Formanek H (2000) A New Chromosome Model. J Struct Biol. 132: (147-161).
Schaper, A., Rößle, M., Formanek, H., Jovin, T. M., Wanner, G. (2000) Complementary Visualization of Mitotic Barley Chromatin by Field-Emission Scanning Electron Microscopy and Scanning Force Microscopy. J. Struc. Biol. 129, 17-29.
Martin, R., Busch, W., Herrmann, R. G., Wanner, G. (1996) Changes in chromosomal ultrastructure during the cell cycle. Chromosome Res. 4, 288-294.
Wanner G and Formanek H (1995) Imaging of DNA in human and plant chromosomes by high-resolution scanning electron microscopy. Chromosome Research 3: (368-374).
Martin, R., Busch, W., Herrmann, R. G., Wanner, G. (1994) Effecient preparation of plant chromosomes for high-resolution scanning electron microscopy. Chrom. Res. 2, 411-415.
Schubert, I., Dolezel, J., Houben, A., Scherthan, H., Wanner, G. (1993) Refined examination of plant metaphase chromosome structure at different levels made feasible by new isolation methods. Chromosoma 102, 96-101.
Wanner, G., Formanek, H., Martin, R., Herrmann, R.G. (1991) High resolution scanning electron microscopy of plant chromosomes. Chromosoma 100, 103-109.